Curare il diabete con le staminali č un mito o una realtā? Il punto della situazione in un position paper della SID
L’avanzamento delle conoscenze nel campo della medicina rigenerativa pone, sempre più spesso, l’attenzione dei pazienti e dei clinici su attese terapeutiche basate su approcci di terapia cellulare. All’interno di questi, le terapie con cellule staminali sono spesso evocate come una possibile opzione terapeutica già in atto o perseguibile nell’immediato futuro per il diabete. Per fare un po’ di chiarezza sull’argomento, la Società Italiana di Diabetologia (SID) ha redatto il documento “Cellule staminali nella terapia del diabete” che esamina tutti i filoni di ricerca in corso nel mondo, da quelli a un passo dalla clinica, a quelli ancora proiettati nel futuro. A questo documento hanno contribuito i ricercatori del Diabetes Research Institute di Milano, del Laboratorio di Ricerca sulle Cellule Staminali dell’Università degli Studi di Verona, del Dipartimento di Medicina Clinica e Sperimentale dell’Università di Pisa, del Dipartimento di Scienze Biomediche, Chirurgiche e Odontoiatriche dell’Università degli Studi di Milano, del Dipartimento di Ingegneria Meccanica e Aerospaziale del Politecnico di Torino, del Dipartimento di Medicina dell’Università di Padova, del Centro Nazionale Trapianti (Area Tessuti e Cellule) e dell’Unità Ricerca e Sviluppo dell’Agenzia Italiana del Farmaco. Difficile riassumere in poche righe tutte le informazioni rilevanti raccolte nel documento originale pubblicato on line su www.siditalia.it ma proveremo a estrarre i concetti più rilevanti.
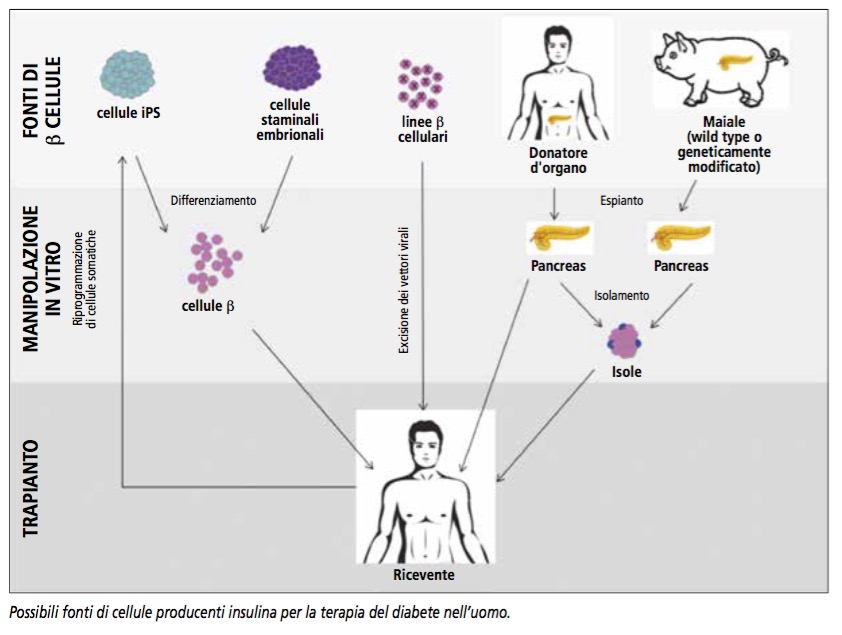
La medicina rigenerativa con cellule staminali ha la potenzialità non solo di trattare, ma di guarire in modo definitivo il diabete e, come in tutti i campi di frontiera, è più che corretto avere una grande fiducia per il futuro, ma è altrettanto necessario mantenere un sano realismo e un doveroso rigore scientifico. L’evoluzione della medicina rigenerativa e lo studio della biologia delle cellule staminali stanno aprendo scenari innovativi nel campo terapeutico. Nonostante questi progressi, al momento tutti i trattamenti con cellule staminali nella sostituzione della funzione beta cellulare non possono essere considerati uno standard clinico e, quindi, vanno considerati puramente sperimentali e da eseguirsi evidentemente solo all’interno di studi clinici approvati. La frontiera più avanzata per le terapie di sostituzione cellulare è costituita dalle cellule staminali pluripotenti, sia embrionali (ESC - Embryonic Stem Cells) che indotte (iPS - Induced Pluripotent Stem). A causa della loro capacità di auto-rinnovarsi e di differenziare in ogni tipo cellulare, le cellule staminali pluripotenti sono considerate la fonte più promettente per terapie di sostituzione cellulare. A coronamento di un lungo percorso di studi preclinici, il 29 Ottobre 2014, ViaCyte, una realtà californiana sostenuta da finanziamenti privati e pubblici, ha annunciato l’inizio di un trial clinico di fase 1/2 (clinicaltrial.gov: NCT02239354) e il trapianto del primo paziente con cellule producenti insulina derivate dalle ESC. Le cellule sono state trapiantate in un dispositivo costituito da una membrana porosa impermeabile alle cellule, chiamato “Encaptra® drug delivery system”. Questo dispositivo è stato creato con l’obiettivo di proteggere le cellule impiantate da un possibile attacco del sistema immunitario, di contenerle permanentemente all’interno e di prevenirne la potenziale distribuzione lontano dal sito d’impianto. Questa è la prima volta in cui è provata, nell’uomo, una terapia di sostituzione ß cellulare basata sulle ESC per la terapia del diabete e rappresenta il culmine di un decennio di sforzi. Nonostante i rilevanti successi ottenuti, tre problemi limitano ancora l’utilizzo in clinica delle cellule producenti insulina derivate dal differenziamento delle ESC. Prima di tutto, data la loro pluripotenza, le cellule indifferenziate sono in grado di portare alla formazione di teratomi in vivo e il trapianto di cellule differenziate non selezionate potrebbe indurre la formazione di tumori causati dalla presenza di alcune cellule indifferenziate residue. Un altro problema irrisolto riguarda l’evidenza che linee diverse di ESC possiedono una differente propensità a dare origine a cellule pancreatiche; di conseguenza, andrebbero provate (con protocolli di differenziamento modificati ad hoc) molte linee cellulari al fine di identificare un set di linee di ESC in grado di facilitare un matching genetico fra donatore e paziente e, quindi, prevenire il rigetto delle cellule trapiantate e l’utilizzo di una terapia immunosoppressiva a vita. L’ultimo grande problema, che attualmente limita l’utilizzo delle ESC in molti paesi del mondo, è la presenza di questioni di tipo etico relative alla distruzione di embrioni umani per la produzione di queste linee cellulari. Per superare questi ostacoli ottenendo ugualmente cellule pluripotenti, il gruppo del Professor Shinya Yamanaka (vincitore del premio Nobel nel 2012 per questa scoperta) nel 2006 è riuscito a riprogrammare cellule somatiche adulte in cellule pluripotenti attraverso l’espressione forzata di 4 geni (OCT4, SOX2, KLF4 e c-MYC) e le ha rinominate cellule staminali pluripotenti indotte (iPSC). Le iPSC conservano le stesse proprietà essenziali delle ESC, inclusa l’abilità di differenziare in ß cellule, ma offrono il vantaggio di permettere la generazione autologa di cellule che potrebbero essere usate per la terapia cellulare. A oggi, il più grande problema delle iPSC, che preclude ancora il loro uso in clinica, è correlato a una loro caratteristica intrinseca: siccome cellule pluripotenti, anche le iPSC determinano la formazione di tumori quando trapiantate in animali immunodeficienti. Altri problemi sono causati dal processo di riprogrammazione stesso, poiché per la trasfezione dei fattori di riprogrammazione sono utilizzati vettori retrovirali integranti che potrebbero causare mutagenesi inserzionale interferendo con la trascrizione di geni e inducendo la formazione di tumori. Per superare questi ostacoli, sono state sviluppate varie strategie: la rimozione dell’oncogene c-Myc dal set di geni richiesto per la riprogrammazione o l’uso di nuove classi di vettori per la riprogrammazione che non integrano nel genoma dell’ospite diminuendo in tal modo drasticamente il rischio di tumorigenesi senza alterare la pluripotenza.
Le cellule staminali possono essere utilizzate per sostituire le cellule produttrici d’insulina mancanti o malfunzionanti, ma anche per mantenere vive le cellule beta pancreatiche proteggendole dall’attacco del sistema immunitario (alla base del diabete di tipo 1) o dal danno legato al “troppo lavoro”, nel diabete di tipo 2. Un numeroso gruppo di ricerche ha sperimentato l’infusione di cellule staminali del midollo osseo (trapianto autologo) all’interno di un’arteria del pancreas o per via sistemica nel tentativo di trattare il diabete di tipo 1 e 2. Nel documento della SID si chiarisce che, al momento, non c’è alcuna prova che quest’approccio funzioni e va, dunque, considerato puramente sperimentale. Solo il monitoraggio a lungo termine dei pazienti trattati fino ad ora potrà chiarirne meglio il rapporto rischio-beneficio.
Le ricerche in corso stanno anche valutando le potenzialità di utilizzare le cellule staminali del cordone ombelicale ma, finora, i risultati non sono stati esaltanti. Su questo bisogna fare particolare chiarezza. Una valutazione tramite rete ha individuato trentadue siti di banche private che promuovono la conservazione del sangue del cordone ombelicale a uso “personale”. Il costo medio per la raccolta e la crioconservazione per circa 20 anni delle cellule del cordone è 2.370 euro (con un range tra 1.570 e 3.100 euro). Una revisione delle informazioni sui benefici della crioconservazione delle cellule dal sangue cordonale rivela un modello d’informazioni confuse e potenzialmente fuorviante. Per quanto riguarda la terapia del diabete, ventotto delle 32 banche considerate riportano nei loro siti web l’utilità della crioconservazione delle cellule staminali del cordone. Nella maggior parte dei casi, il diabete compare come una delle patologie che potranno essere curate in futuro e per le quali esistono dei trial clinici volti a determinarne l’efficacia. Al momento, però, l’uso di sangue di cordone autologo, come fonte di cellule immunomodulatrici per la terapia del diabete di tipo 1, è stato inefficace. Non c’è, quindi, indicazione alla sua conservazione finalizzata al trattamento del diabete.
L’evoluzione della medicina rigenerativa e lo studio della biologia delle cellule staminali stanno aprendo scenari innovativi anche nel campo terapeutico. Nonostante questo, al momento, tutti i trattamenti elencati in questo documento non possono essere considerati uno standard clinico: pertanto, devono essere eseguiti solo all’interno di studi clinici approvati dai comitati etici e dalle rispettive autorità regolatorie competenti. Al fine di poter meglio informare i pazienti, si segnala che l’International Society for Stem Cell Research ha stilato delle Linee Guida per i pazienti sulla partecipazione a trial con terapia cellulare tradotti in molte lingue, compreso l’italiano, che si possono trovare nel web all’indirizzo: http://www.closerlookatstemcells.org/docs/default-source/patient-resources/patient-handbook---italian.pdf?sfvrsn=4
Lorenzo Piemonti
Deputy Director Diabetes
Research Institute
IRCCS Ospedale San Raffaele
Milano
Tratto da: Cardiolink, 05 settembre 2016

